Importance de la fraction alvéolaire (FA)
Le but principal de l’anesthésie par inhalation est d’apporter au niveau du cerveau (organe-cible de la perte de connaissance) une concentration efficace d’un agent volatil halogéné. Notons que cette "concentration efficace" est aussi bien exprimée par la "fraction efficace".
Les moyens de cette anesthésie associent :
• un appareil délivrant l’halogéné (évaporateur le plus souvent) ;
• un flux de gaz vecteur (O2, N2O, air) entraînant l’halogéné ;
• la ventilation du patient, spontanée ou contrôlée.
Tout cela est illustré par la figure 1 :
1. Le mélange de gaz vecteur emporte les vapeurs d’agent halogéné dans les voies aériennes. Chaque inspiration du patient contient une "dose" d’halogéné arrivant dans les alvéoles pulmonaires.
2. Après diffusion alvéolo-capillaire, l’agent halogéné "circule" dans l’organisme qu’il imprègne au fil du temps. La ventilation minute (VM) du patient représente une répétition des doses et permet ainsi l’administration continue de l’halogéné.
Les différents tissus de l’organisme vont être imprégnés de manière inégale selon :
• l’importance de leur vascularisation sanguine ;
• l’importance de leur structure graisseuse, les halogénés étant liposolubles (à des degrés divers).
3. C’est ainsi que le cerveau (richement vascularisé) est imprégné rapidement, ce qui répond bien au but de l’anesthésie.
4. C’est ainsi que les graisses périphériques (faiblement vascularisées) sont imprégnées lentement.
5. Les autres tissus de l’organisme vont fixer des quantités variables de l’agent halogéné.
6. Le sang veineux qui retourne vers les poumons présente une concentration diminuée en agent halogéné (par rapport au sang artériel), à cause de la fraction d’halogéné fixée dans les tissus (captation périphérique).
Le gradient de concentration entre sangs veineux et artériel facilite la diffusion de l’agent halogéné de l’alvéole vers le sang, entraînant un véritable "lavage" de l’alvéole par l’augmentation du gradient alvéolo-capillaire.
C’est pourquoi à l’introduction* de l’halogéné il faut maintenir un apport soutenu en vapeurs d’halogéné, tant que n’est pas atteint de manière stable le niveau désiré (pseudo-plateau que l’on cherche à établir). Si l’on ne respecte pas cette règle, le risque est de ne pas maintenir le niveau anesthésique désiré et de voir le patient se réveiller.
Au total, l’alvéole pulmonaire se comporte comme la "plaque tournante" de la circulation de l’agent halogéné dans l’organisme.
Connaître la fraction alvéolaire en halogéné (FA) permet de gouverner l’anesthésie, puisque le choix de la profondeur de l’anesthésie est lié à la concentration alvéolaire minimale (CAM ou MAC) déterminée pour chaque halogéné (1).
En pratique, on mesure la fraction d’halogéné de fin d’expiration (FE) qui est très proche de la FA. Le mot "introduction" est employé ici comme wash-in des Anglo-Saxons. Le mot "induction" définit plutôt le réel début de l’anesthésie, par injection intraveineuse le plus souvent.
REPERES
1- Le réglage sur l’évaporateur de la fraction délivrée (FD) va gouverner la FA par le biais de la fraction inspirée (FI) : plus la FD est élevée, plus la FI est élevée, plus la FA sera élevée.
2- Le réglage des débits de gaz détermine le flux total de gaz vecteur (débit de gaz frais = DGF), dont le rôle est très important :
• en circuit ouvert (haut débit de gaz frais : en général égal à la ventilation minute du patient, VM), l’apport en halogéné est important, la FI est égale à la FD ;
• en circuit semi-fermé (débit de gaz frais inférieur à la ventilation minute du patient), l’apport en halogéné est plus faible, et la FI est inférieure à la FD pendant un certain temps ;
• en circuit fermé (bas débit de gaz frais, souvent fixé de manière arbitraire à 1 l/min), l’apport en halogéné est encore plus faible ; la FI reste longtemps très inférieure à la FD ;
• en circuit fermé "strict" (très bas débit de gaz frais, approchant la consommation en O2 du patient), l’apport en halogéné est au minimum, la FI reste très basse très longtemps.
La figure 2** illustre la différence entre circuit ouvert et circuit fermé.
3- La ventilation du patient
Celle-ci peut être résumée par une formule simple :
VA = (VT-VD) x f
oùVA : Ventilation alvéolaire
VT : Volume courant
VD : Espace mort
f : fréquence respiratoire
Cette formule explique bien pourquoi la ventilation contrôlée (mécanique) du patient entraîne une meilleure ventilation alvéolaire que la respiration spontanée : sous ventilation mécanique, le volume courant n’est plus soumis à l’effet des narco-hypnotiques ou des curares, la fréquence respiratoire n’est pas soumise à l’action des opiacés. Dès lors, la montée de la FA est conditionnée par la qualité de la ventilation (VA) (fig. 3).
4- Difficultés à connaître
Deux d’entre elles peuvent se produire dans les circonstances quotidiennes :
• Les incidents et accidents respiratoires lors de l’introduction de l’halogéné en ventilation spontanée peuvent être responsables d’une baisse de la VA, et donc d’un ralentissement de la montée de la FA (ou FE) de l’halogéné. L’influence de la ventilation sur la FA est bien connue (2, 4).
Rappelons que : VA = (VT - VD) x f
Donc : Vont diminuer f : toux, spasme, hoquet, pauses respiratoires, opiacés...
Vont diminuer VT : narco-hypnotiques de l’induction, curares dépolarisants, fortes concentrations de l’agent halogéné... (fig. 4)**.
• Les perturbations du débit cardiaque peuvent jouer, en pratique, un rôle très important. Rappelons en effet que les perturbations du débit cardiaque modifient la montée de la FA de l’agent halogéné, selon l’effet de "lavage" de l’alvéole (cf. : fig. 1, point 6).
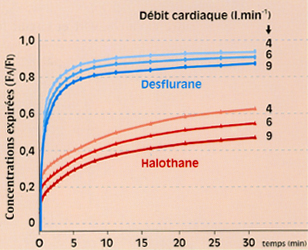
Dans les situations où le débit cardiaque est abaissé (situations en général graves pour le patient), la FA monte rapidement (fig. 5), et le danger d’apport trop élevé d’agent halogéné existe, avec les effets indésirables et/ou toxiques.
• Dans les deux circonstances ci-dessus, seule la surveillance de la FA (FE), monitorage par analyseur, permet au clinicien d’éviter le surdosage... ou le sous-dosage.
SUBTILITES
Elles découlent des propriétés physico-chimiques des différents agents volatils halogénés, et principalement de la liposolubilité, exprimée par les coefficients de partage chez l’adulte (tableau I).
1- La manière de régler l’évaporateur sera différente suivant l’agent halogéné utilisé.
La FE (ou FA) suit donc la FI (voir ci-dessus). Mais la FE est d’autant plus proche de la FI que l’agent halogéné est peu liposoluble, évitant la captation périphérique (fig. 6)**.
Conséquences pratiques :
• Avec un agent halogéné peu liposoluble (ex. : Suprane®, DCI : desflurane), la FE rejoint rapidement la FI (laquelle est proche de la FD en circuit ouvert). En termes simples, on "affichera" une concentration proche (ou presque) de celle que l’on désire comme FE.
L’utilisation de fortes concentrations ("overpressure" des Anglo-Saxons) n’est pas nécessaire en circuit ouvert.
• Avec un agent halogéné plutôt liposoluble (ex. : AErrane®, DCI : isoflurane), la FE rejoint lentement la FI. Afin de n’être pas pris par le temps, au début de l’intervention, l’anesthésiste affichera une concentration sur l’évaporateur (FD) supérieure à celle qui est désirée ("overpressure") afin d’atteindre rapidement ce qui est désiré (fig. 7)**.
Dans ce cas, la surveillance attentive de la FE est donc impérative, pour éviter le surdosage.
2- Le choix du débit de gaz frais est aussi dicté par les propriétés physiques de l’agent halogéné introduit.
Si l’on désire utiliser un bas débit de gaz frais dès le début, il faut que le relais de l’agent intraveineux (induction) par l’halogéné soit rapide :
• Avec un agent halogéné peu liposoluble (ex. : Suprane®), il est possible d’obtenir rapidement ce relais par l’halogéné, avec une surconcentration habituelle (FD = 2 à 3 fois la FE désirée) (fig. 8)**. Le délai auquel on atteint le niveau désiré du pseudo-plateau de la FE est alors du même ordre que dans les circonstances du circuit ouvert.
• Avec un agent halogéné plutôt liposoluble (ex. : AErrane®), il paraît très difficile de réaliser rapidement ce relais, surtout après un agent intraveineux d’induction moderne et de cinétique rapide (type propofol). Comme l’illustre la lenteur d’ascension de la FE et, malgré la surconcentration, un tel halogéné ne paraît pas convenir à cette situation (fig. 9)**.
Si l’on désire introduire l’halogéné avec un grand débit de gaz frais (circuit ouvert), l’halogéné le moins soluble permet ensuite de réduire le débit de gaz frais (passage au circuit fermé) plus précocement qu’un agent plus soluble comme l’ont montré Lee et coll. dans leur comparaison desflurane/isoflurane (5).
Dans tous les cas, la surveillance de la FE (FA) par monitorage continu est indispensable pour éviter le surdosage.
3- Qu’en est-il du cerveau
La corrélation entre la fraction alvéolaire en agent anesthésique et la concentration cérébrale atteinte est très peu documentée.
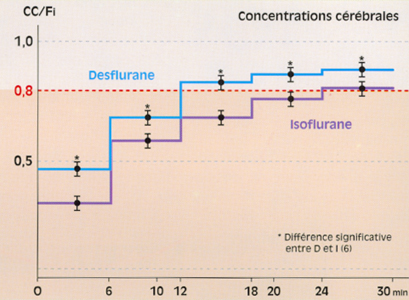
Un travail expérimental sur le lapin (6) démontre bien cette corrélation cinétique, mesurant les concentrations cérébrales (CC) des agents halogénés par résonance magnétique nucléaire. Les concentrations cérébrales atteignent le niveau des fractions alvéolaires avec quelques minutes de délai.
Chez l’animal, le desflurane est 1,7 fois plus rapide que l’isoflurane (fig. 10).
En pratique, ne pouvant mesurer la concentration cérébrale, l’anesthésiste se guidera sur le monitorage de la FE qui en est donc proche.
CONCLUSION
La fraction alvéolaire (FA) d’un agent anesthésique halogéné est la "plaque tournante" de l’anesthésie par inhalation. En pratique, on mesure la FE (concentration télé-expiratoire de l’halogéné) avec un analyseur.
La mise au point de respirateurs permettant les bas débits de gaz frais modifie les techniques d’anesthésie inhalatoire et impose la présence de l’analyseur.
Un halogéné peu liposoluble (ex. : desflurane) répond mieux aux exigences de rapidité des bas débits de gaz frais, et l’analyseur objective la vitesse avec laquelle on atteint le niveau désiré d’anesthésie.
Bibliographie
1. BUNODIERE M., LAPEYRE G. -
Ce que vous vous êtes souvent demandé sur la MAC.
Vocation Hôpital, 1996 ; 8 : 2-6.
2. DERIAZ H., MURAT I. - Agents halogénés et protoxyde d’azote. In : SAMII K éd. Anesthésie-Réanimation chirurgicale 2e éd. Paris : Flammarion Médecine - Sciences, 1995 : 203-212.
3. EGER E. I. - Desflurane (Suprane®) : a compendium and reference. Anaquest ed., 1993, 119 p.
4. EGER E. I. - Uptake and distribution. In : MILLER R. D. Anesthesia 4th ed. New-York : Churchill Livingstone, 1994 : 101-123.
5. LEE D. J. H., ROBINSON D. L.,
SONI N. - Efficiency of a circle system for short surgical cases : comparison of desflurane versus isoflurane. Br. J. Anaesth., 1996 ; 76 : 780-782.
6. LOCKHART S. H., COHEN Y., YASUDA N. et al. - Cerebral uptake and elimination of desflurane, isoflurane, and halothane from rabbit brain : an in vivo NMR study. Anesthesiology, 1991 ; 74 :
575-580.
Fig 1 Cinétique d'un agent halogéné lors de son introduction (ou induction par inhalation), se reporter au texte.
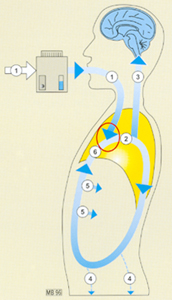
Fig 2 Evolution de la fraction télé-expiratoire (Fe) du desflurane : comparaison circuit ouvert/circuit fermé, en ventilation controlée.
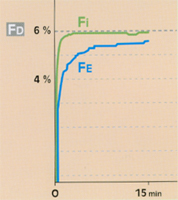
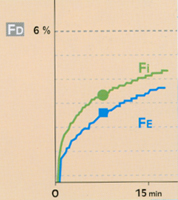
Fig 3 Evolution de la fraction télé-expiratoire (Fe) du desflurane lors d'une anesthésie selon le mode ventilatoire en circuit ouvert : comparaison ventilation controlée/ventilation spontanée.
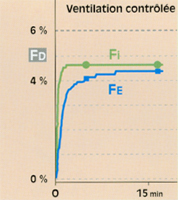
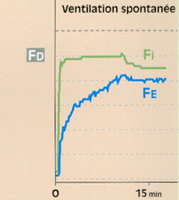
Fig 4 Evolution de la fraction télé-expiratoire (Fe) du desflurane en ventilation spontanée lors d'une anesthésie. On remarque bien que la montée de la Fe est ici plus lente que dans les exemples précédents, du fait de l'installation lente (6 à 7 mn.) d'une ventilation spontanée efficace (courbe du bas).
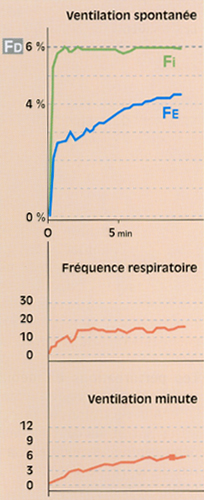
Fig 5 Modifications de la montée de la Fa (exprimée en rapport Fa/Fi) d'un agent halogéné, en fonction du débit cardiaque.
tab 1 Coefficients de partage de quelques halogénés chez l'adulte (d'après 2).
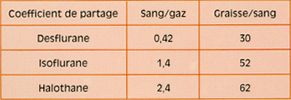
Fig 6 Evolution comparée de la fraction télé-expiratoire (Fe) du Suprane© et de l'AErrane© (ventilation controlée en circuit ouvert.
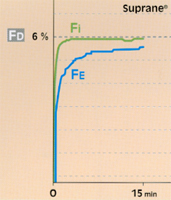
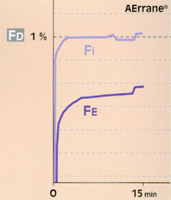
Fig 7 Réglage de l'évaporateur (Fd) à l'introduction du gaz, selon la liposolubilité de l'agent halogéné : comparaison du Suprane© et de l'AErrane© pour obtenir un même niveau désiré (1MAC), en circuit ouvert et ventilation controlée.
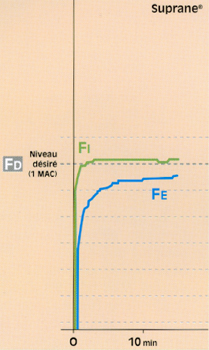
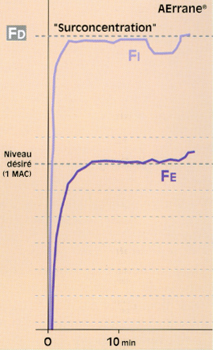
Fig 8 Evolution de la fraction télé-expiratoire (Fe) de Suprane© en circuit fermé (0,6 l/min) et ventilation controlée.
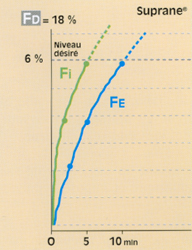
Fig 9 Evolution de la fraction télé-expiratoire (Fe) de l'AErrane© en circuit fermé (0,6 l/min) et ventilation controlée.
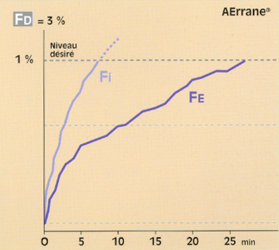
Fig 10 Evolution du rapport CC/Fi chez le lapin, d'après LOCKHART (6) : comparaison du desflurane et de l'isoflurane.