Elimination de l’agent halogéné
La définition du réveil n’a pas encore fait l’objet d’un consensus. On peut tenter de le définir comme le délai qui va du "dernier acte technique nécessitant le maintien au bloc opératoire et la poursuite de l’acte anesthésique" jusqu’à la "fin des effets des agents utilisés pour établir l’anesthésie". De plus, "si le début de cette période est facile à déterminer, [...] sa fin est fixée par l’anesthésiste à partir des critères dont il est responsable (1)".
Cette période du réveil peut être divisée en différentes phases qui se succèdent au fil des heures ; de nombreuses propositions ont été faites (18) et l’on peut citer par exemple :
• Le réveil précoce (early emergence
ou immediate recovery) avec : retour grossier de la conscience, récupération des réflexes laryngés, ouverture des yeux et serrement de main à la commande...
• Le réveil complet, plus tardif (late recovery), jugé sur l’association de différents tests : orientation temporo-spatiale et récupération d’une coordination motrice (station assise, station debout, déambulation, épreuve de Romberg...), scores de réveil (Aldrete, Steward). Plusieurs critères associés permettent de définir l’aptitude du patient à quitter la salle de surveillance postinterventionnelle (8) et/ou à retourner à la maison.
• La normalisation des tests psychomoteurs complexes, nombreux dans la littérature (7, 10, 16), que l’on peut qualifier de street fitness (littéralement "aptitude à la rue").
• La récupération complète avec normalisation des fonctions supérieures (coordination psychomotrice, mémoire, fonctions cognitives), qui peut prendre plus de 24 heures.
Il n’y a de consensus ni sur ces phases ni sur les tests pour les évaluer (on peut aussi bien proposer : la capacité de déglutir sans fausse route, la stabilité tensionnelle, l’absence de nausées...).
Néanmoins, cette distinction en phases successives permet de comparer les différentes techniques d’anesthésie au moment du réveil ; elle permet surtout de juger de l’aptitude du patient à quitter la salle de surveillance postinterventionnelle.
RÉVEIL DE L’ANESTHÉSIE
PAR INHALATION
I - Elimination de l’agent halogéné.
Le "réveil" de l’anesthésie par inhalation résulte de l’élimination de l’agent halogéné au niveau du cerveau (organe cible).
Cela est conditionné par deux facteurs principaux :
— l’arrêt de l’administration de l’halogéné (FD = 0), suivi d’une chute brutale de la fraction inspirée (FI = 0), qui entraîne rapidement une chute de la pression partielle de l’agent halogéné dans le sang parvenant au cerveau ;
— une bonne ventilation alvéolaire, assurant l’élimination pulmonaire, qui, associée à un bon état hémodynamique, explique la chute brutale de la concentration cérébrale de l’agent halogéné.
En pratique (figure 1) :
1. Les mécanismes du "réveil" de l’anesthésie par inhalation commencent quand on arrête l’administration de l’agent halogéné par fermeture du vernier de l’évaporateur. Le mélange gazeux inhalé ne contient plus d’agent s’il n’y a pas de réinhalation (haut débit de gaz frais).
2. Le gaz alvéolaire est, à chaque inspiration, dilué par du gaz frais.
3. Le sang parvenant au cerveau est pauvre en agent halogéné. Le gradient de concentration s’inverse, le cerveau se débarrasse de l’agent halogéné dans le sang retournant vers les poumons.
NB : contrairement à la période d’induction, on ne peut pas s’appuyer sur l’effet concentration : la concentration cérébrale à l’arrêt de l’anesthésie est en général proche de la MAC, et le zéro ne peut être abaissé.
Dès lors la décroissance de l’halogéné, proche de l’exponentielle, se situe à l’intérieur de ces deux limites.
4. Au niveau des tissus et de la circulation périphériques, les gradients s’inversent aussi : dans chaque circulation locale, les concentrations baissent au fil du temps.
NB : l’importance et la durée de ces phénomènes dépendent de l’état d’équilibre précédemment atteint (la liposolubilité de l’agent halogéné et la durée de l’anesthésie déterminent principalement la quantité d’agent fixée par les différents tissus), des débits sanguins locaux, du degré d’épuration du sang revenant vers les tissus. Au total, les différents tissus de l’organisme se comportent comme autant de réservoirs qui délivrent de l’agent halogéné (9).
5. Le sang qui retourne vers les poumons est donc chargé d’une certaine quantité d’agent halogéné qui s’oppose au "lavage" des alvéoles par la respiration.
6. Au niveau alvéolaire, la décroissance de la concentration en halogéné (FA) est très rapide au début, puisque l’effet de lavage de la capacité résiduelle fonctionnelle (CRF) par la ventilation est très rapide (phénomène inverse de l’induction). Ensuite, la décroissance est moins rapide car le gradient s’amenuise
au fil des minutes : d’une part la concentration alvéolaire diminue, d’autre part le sang provenant de la périphérie continue à évacuer l’agent halogéné des tissus.
II - Remarque
La ventilation alvéolaire conditionne le bon déroulement de tous ces mécanismes du réveil. Ainsi l’anesthésiste surveille-t-il particulièrement les causes d’hypoventilation alvéolaire à la période du réveil, évitant par exemple la rémanence des effets des curares (diminution du volume courant) ou bien une trop forte imprégnation morphinique résiduelle (diminution de la fréquence respiratoire). Une sédation résiduelle, d’origine plus insidieuse, peut aussi retarder les phénomènes du réveil, comme parfois rapporté après utilisation d’une benzodiazépine en prémédication (3) ou pour l’induction (17).
III - En résumé
Le réveil de l’anesthésie par inhalation est donc sous la dépendance étroite de la concentration alvéolaire de l’agent halogéné. La notion de "MAC-AWAKE" n’est pas d’une grande fiabilité (5). C’est pourquoi seule la surveillance de la fraction expirée (FE) de l’agent halogéné grâce à un analyseur de gaz permet de suivre l’évolution et la rapidité de la chute de la concentration alvéolaire, donc le réveil.
ASPECTS CINÉTIQUES ET CLINIQUES
I - Effet de la liposolubilité sur
les courbes cinétiques d’élimination.
Après arrêt de l’administration de l’agent halogéné, la courbe de décroissance alvéolaire d’un agent peu liposoluble (ex : desflurane) est plus rapide que celle d’un agent plutôt liposoluble (ex : isoflurane) (12, 20), puisque les quantités fixées à la périphérie sont moins importantes pour l’agent peu liposoluble. Le relargage d’agent halogéné dans l’alvéole, par le sang de retour, s’oppose moins longtemps à l’effet de lavage alvéolaire de la ventilation.
Cela est montré par la figure 2.
En pratique, la rapidité cinétique de l’élimination du desflurane est objecti-vée par la chute brutale de la FE suivant l’arrêt de l’administration (figure 3)*.
II - Effet de la liposolubilité sur les résultats cliniques. Conformément aux résultats des études cinétiques, la rapidité du réveil dépend en grande partie de la liposolubilité de l’agent halogéné (9). En effet, un agent peu liposoluble (ex : desflurane) atteint rapidement les basses concentrations du réveil clinique. En revanche, un agent plutôt liposoluble (ex : isoflurane) approche plus vite, au fil du temps, l’équilibre entre la fraction alvéolaire et les tissus, ce qui prolonge les phénomènes du réveil (9).
Le réveil plus rapide avec le desflurane, comparé à l’isoflurane, se retrouve aussi bien chez l’enfant et le sujet âgé que chez l’adulte. Cela est illustré par les figures 4, 5 et 6.
III - Exemple des anesthésies de longue durée. Après une anesthésie de longue durée par inhalation, le réveil semble meilleur avec un agent halogéné peu liposoluble (ex : desflurane), comparé à un agent plutôt liposoluble (ex : isoflurane) : les délais de réveil sont deux fois plus rapides (2, 11) et la récupération des fonctions vitales et cognitives semble aussi plus rapide (2, 15).
En pratique, la rapidité cinétique de la décroissance de la FE du desflurane après anesthésie de longue durée est très proche des résultats observés après anesthésies de brève ou moyenne durée. Cela est illustré par la figure 7*.
REMARQUES
I - Importance du débit de gaz frais au réveil. L’élimination de l’agent halogéné par l’organisme est aussi sous la dépendance du débit de gaz frais (DGF) qui traverse le circuit (ce débit est déterminé par les rotamètres).
— Un grand DGF va d’une part "rincer" l’intérieur du circuit (ballon, tuyaux, bac à chaux sodée...) de son contenu en halogéné ; d’autre part, il assure un effet de lavage alvéolaire plus important et plus rapide (pas de réinhalation). Un DGF égal ou supérieur à la ventilation/minute du patient (VM) réalise cela, une valve sans réinhalation (VSR) aussi — A l’inverse, plus le DGF est bas (plus ou moins inférieur à la VM) au moment du réveil, plus l’agent halogéné reste dans le circuit, et plus l’effet de lavage alvéolaire est retardé (importante réinhalation).
La figure 8* illustre cela à l’aide de 3 DGF différents utilisés au moment de l’élimination de l’halogéné.
II - Exemple du patient obèse.
L’obésité est un bon modèle clinique pour juger de l’élimination d’un agent halogéné, puisque, éventuellement la liposolubilité de l’agent halogéné, et surtout l’altération des mécanismes de la respiration peuvent retentir sur la ventilation alvéolaire encore plus nettement que sur le sujet de poids normal (4).
Le choix d’un agent halogéné peu liposoluble (ex : desflurane), associé à un haut DGF, devrait permettre d’obtenir chez l’obèse une rapidité d’élimination comparable à celle du sujet de poids normal. Cela est illustré par la figure 9*.
Des études sont en cours pour vérifier la réalité clinique de la théorie cinétique.
III - Qu’en est-il du cerveau De même que pour l’introduction du gaz à l’induction (6), la corrélation entre la baisse de la concentration cérébrale et la baisse de la fraction alvéolaire a fait l’objet de très peu d’études.
Un travail expérimental sur le lapin (14) démontre la corrélation cinétique, en mesurant les concentrations cérébrales (CC) des agents halogénés par résonance magnétique nucléaire. Les concentrations cérébrales suivent les fractions alvéolaires avec quelques minutes de délai. Chez l’animal, le taux d’élimination cérébrale du desflurane est 1,7 fois plus rapide que pour l’isoflurane (fig 10). En pratique, chez l’homme, ne pouvant mesurer la concentration cérébrale, l’anesthésiste se guidera sur le monitorage de la FE qui en est donc proche.
Au total, la connaissance des mécanismes du réveil de l’anesthésie par inhalation (élimination de l’halogéné) tend à donner l’avantage à un agent peu liposoluble :
— décroissance rapide de la FE (12, 20) ;
— réveil clinique rapide et clair (2, 7, 9, 11, 13, 15, 19).
Bibliographie
1. BANSSILLON V, CARRY PY. Réveil. In SAMII K ed. Anesthésie Réanimation chirurgicale. Paris, Flammarion Médecine-Sciences : 1990 : 271-277
2. BEAUSSIER M, DERIAZ H, ADELAHIM Z, AISSA F, LIENHART A. Comparative effects of desflurane and isoflurane on recovery after long-lasting anaesthesia. Canadian Journal of Anaesthesia 1998 ; 45 (5) :
429-434.
3. BEVAN JC, VEALL GR, MACNAB AJ, RIES CR, MARSLAND C. Midazolam premedication delays recovery after propofol without modifying involuntary movements. Anesth Analg 1997 ; 85 : 50-54
4. BRUDER N, PINHAS JM, FRANCOIS G. Anesthésie de l’obèse. Encycl Med Chir (Elsevier, Paris). Anesthésie-Réanimation, 36650 C10. 1994 ; 8 p.
5. BUNODIERE M., LAPEYRE G. Ce que vous vous êtes souvent demandé sur la Mac. Vocation Hôpital 1996 ; 8 : 2-6
6. BUNODIERE M. Anesthésie par inhalation, introduction du gaz : importance de la fraction alvéolaire (FA). Vocation Hôpital 1997 ; 9 : 2-8
7. EGER EI. Desflurane (Suprane®) : A compendium and Reference. Anaquest ed : 1993 : 119 p.
8. EGER EI. New inhaled anesthetics. Anesthesiology 1994 ; 80 : 906-922
9. EGER EI. Uptake and distribution. In : MILLER RD. Anesthesia (4th ed.) New-York, Churchill-Livingstone : 1994 : 101-123
10. HINDMARCH I, BHATTI JZ. Recovery of cognitive and psychomotor function following anaesthesia. A review. In HINDMARCH I, JONES JG, MOSS E eds. Aspects of recovery from anesthesia. John Wiley & Sons : 1987 : 113-126.
11. JUVIN P, SERVIN F, GIRAUD O, DESMONTS JM. Emergence of elderly patients from prolonged desflurane, isoflurane, or propofol anesthesia. Anesth Analg 1997 ; 85 : 647-651
12. LEE C, KWAN WF, TSAI SK, GREEN BJ, CHENG M. A clinical assessment of desflurane anaesthesia and comparison with isoflurane. Can J Anaesth 1993 ; 40 : 487-494
13. LOAN PB, MIRAKHUR RK, PAXTON LD, GASTON JH. Comparison of desflurane and isoflurane in anaesthesia for dental surgery. Br J Anaesth 1995 ; 75 : 289-292
14. LOCKHART SH, COHEN Y, YASUDA N et al. Cerebral uptake and elimination of desflurane, isoflurane, and halothane from rabbit brain : an in vivo NMR study. Anesthesiology 1991 ; 74 : 575-580
15. APFELBAUM JL, LICHTOR JL, LANE BS,
COALSON DW, KORTTILA KT.
Awakening, clinical recovery, and psychomotor effects after desflurane and propofol anesthesia. Anesthesia and Analgesia 1996 ; 83(4) : 721-725
16. PAUT O, VERCHER JL, QUERUEL P. Tests psychomoteurs de la période de réveil. Encycl Med Chir (Elsevier, Paris). Anesthésie-Réanimation, 36395 A10. 1991 ; 8 p.
17. SERVIN F. Pharmacologie des benzodiazépines utilisées en anesthésie - réanimation. Encycl Med chir (Elsevier, Paris). Anesthésie - Réanimation, 36 369 B10. 1995 ; 11 p.
18. WETCHLER BV. Problem solving in the Postanesthesia Care Unit. In : WETCHLER BV ed. Anesthesia for ambulatory surgery (2nd edition) Philadelphia : JB LIPPINCOTT : 1991 : 375-434
19. WOLF AR, LAWSON RA, DRYDEN CM, DAVIES FW. Recovery after desflurane anaesthesia in the infant : comparison with isoflurane. Br J Anaesth 1996 ; 76 : 362-364
20. YASUDA N, LOCKHART SH, EGER EI et al. Kinetics of desflurane, isoflurane and halothane in humans. Anesthesiology 1991 ; 74 : 489-498
Fig 1 Cinétique d'un agent halogéné lors de son élimination à la période du réveil, se reporter au texte.
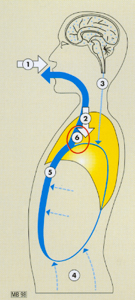
Fig 2 Courbes de décroissance de la fraction expirée d'halogéné après arrêt de l'administration (d'après 12) : comparaison desflurane (DF) versus isoflurane IF. Les points représentent les moyennes +- écarts à la moyenne (p<0,05 à chaque min).
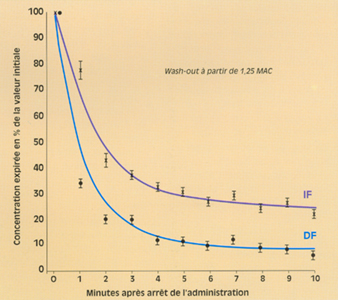
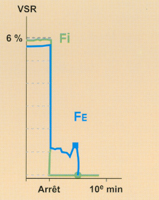
Fig 3 Evolution de la courbe de Fe à l'arrêt de l'administration de l'halogéné, en ventilation spontanée et haut débit de gaz frais (DGF>VM) : comparaison Suprane© versus AErrane©.
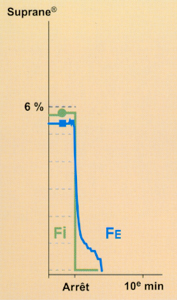
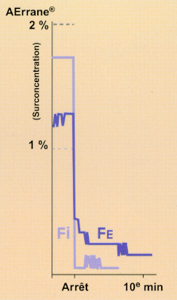
Fig 4 Comparaison de différents scores de réveil à l'arrêt de l'anesthésie chez le nourrisson (19) : moyennes +- déviation standard.
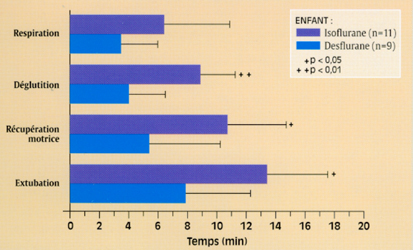
Fig 5 Comparaison de différents scores de réveil à l'arrêt de l'anesthésie chez l'adulte (d'après 13) : moyennes +- déviation standard, p<0,0001 pour tous les scores.
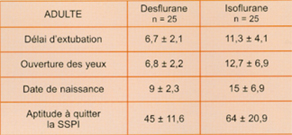
Fig 6 Comparaison de différents scores de réveil à l'arrêt de l'anesthésie chez le sujet agé (d'après 11) : moyennes +- déviation standard, p<0,05 pour tous les scores.
Fig 7 Evolution de la courbe de Fe à l'arrêt de l'administration de Suprane© sous ventilation spontanée et haut débit de gaz frais (DGF>VM), après une anesthésie de 5,5 Heures en ventilation controlée * (cf. légende).
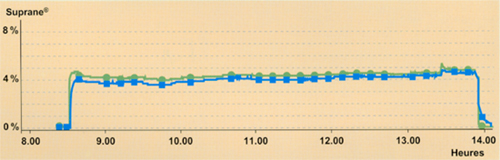
Fig 8 Evolution de la courbe de Fe à l'arrêt de l'administration de Suprane©, en ventilation spontanée : comparaison de 3 DGF différents.
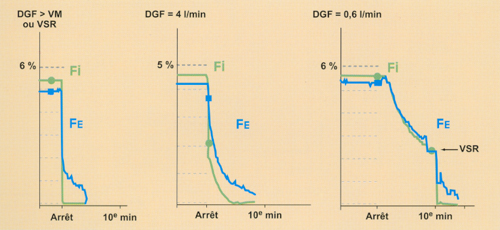
Fig 9 Evolution de la courbe de Fe à l'arrêt de l'administration de Suprane©, en ventilation spontanée chez une femme obèse de 105 Kg.